Como Sabemos Se os Átomos Existem Realmente?
O atomismo tem no mínimo 2.400 anos mas faz menos de um século que ele se afirma como uma grande teoria científica, bem corroborada, frutífera e com poder explicativo sobre o mundo. Após mais de dois séculos de pesquisas, os cientistas não somente descobriram como os átomos são, mas também suas estruturas complexas e as suas mudanças – muitas das quais ocorrem naturalmente. Contudo, ainda persiste um certo ceticismo em relação à existência real dos átomos. Como sabemos que os átomos existem se eles não podem ser vistos?
O atomismo é uma concepção que existe desde a Antiga Grécia, mas que passou a adquirir o status de teoria científica no século XIX. Inicialmente químicos e depois físicos, quase concomitantemente, desenvolveram um "teoria cinética da matéria" onde os átomos desempenham um papel central. Contudo, no final do século XIX e início do século XX havia também uma fortíssima oposição ao atomismo por parte de físicos e químicos positivistas.
A oposição dos positivistas à existência dos átomos passava por argumentos como "se os átomos existem como ninguém até hoje os viu?". Segundo os próprios pressupostos da Teoria Atômica, os átomos não eram observáveis diretamente e, portanto, de acordo com os ditames da filosofia positivista "não existiam e a ciência se faz com aquilo que se observa".
O triunfo da concepção atomista sobre os seus fortes opositores muito se deveu a um dos três importantes trabalhos de Einstein em 1905, a saber: sobre o efeito fotoelétrico (que o levou ao prêmio Nobel em 1921); sobre a eletrodinâmica do corpos em movimento (depois conhecido como o trabalho sobre a Relatividade Restrita); sobre o movimento browniano. Este últimos se constituiu em uma "tremenda prova" sobre a existência dos átomos e moléculas, convencendo alguns dos importantes opositores do Atomismo. Mas houve outras "provas" sobre a existência das tais partículas microscópicas como, por exemplo, a cintilação de uma tela de material fluorescente nas proximidades de uma fonte radioativa.
Mais ou menos ao mesmo tempo, no início do século XIX, duas leis químicas foram enunciadas. Ambas são parte do que hoje conhecemos como leis estequiométricas . Uma dessas leis é conhecida como a Lei de Proust , ou Lei das Proporções Constantes. Ela diz que, quando dois elementos químicos se combinam para formar um composto sempre os fazem na mesma proporção em massa. Como um exemplo prático, vejamos o caso da água. Se decompormos totalmente 1 kg de água nos seus elementos constituintes, vamos observar que aproximadamente 888 gramas têm correspondência com o oxigênio, enquanto que o resto (112 gramas) correspondem ao hidrogênio. Se decompormos um grama, vemos que a mesma proporção é mantida. Qualquer quantidade de água consiste em aproximadamente 88,8% de oxigênio e 11,2% de hidrogênio. Se continuarmos a diminuir a amostra, deve chegar um momento em que não poderemos dividi-la mais.
A segunda lei é a Lei das Proporções Múltiplas , enunciado pelo químico e físico britânico John Dalton, desenvolvida seguindo o mesmo raciocínio de Proust. Se a Lei de Proust nos diz que os elementos estão sempre combinados na mesma proporção para dar os mesmos compostos (que nos fez suspeitar de que deve haver átomos), a Lei das Proporções Múltiplas nos diz algo igualmente importante: que os elementos podem ser combinados em conjunto para formar mais de um composto diferente (o que Proust não tinha levado em consideração), e que também se combinam sempre seguindo certas proporções.
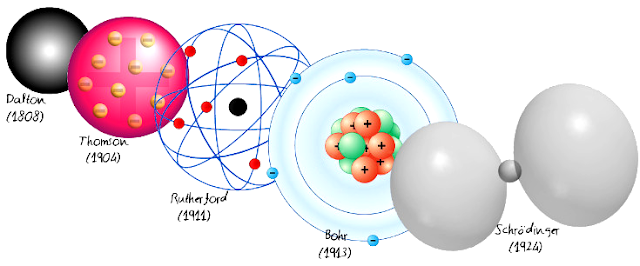
Dalton, tendo em vista estes resultados, publicou o primeiro modelo atômico com uma base científica, hoje conhecido por modelo atômico de Dalton .
Em 1785, o cientista holandês Jan Ingenhousz estava estudando partículas minúsculas de carvão se movimentavam com rapidez na superfície de um recipiente com álcool em seu laboratório. Cerca de 50 anos depois, em 1827, o botânico escocês Robert Brown descreveu algo curiosamente parecido. Ele observava grãos de pólen com seu microscópio e notou que alguns deles soltavam pequenas partículas – que se afastavam dos grãos de uma forma agitada e aleatória.
Em princípio, Brown se perguntou se as partículas eram alguma espécie de organismo desconhecido. Ele repetiu a experiência com outras substâncias como poeira de rocha, que nunca esteve viva, e observou o mesmo movimento estranho de novo.
Ainda levaria quase um século para a ciência chegar a uma explicação desse fenômeno. Albert Einstein desenvolveu uma fórmula matemática que previa esse tipo de movimento particular – então chamado de movimento Browniano, em homenagem a Robert Brown.
A teoria de Einstein era de que as partículas dos grãos de pólen se movimentavam porque estavam constantemente se chocando com milhões de moléculas minúsculas de água.
Em 1908, observações reforçadas com cálculos haviam confirmado a teoria, e em uma década os físicos conseguiram ir além. Ao separar cada átomo individual, eles começaram a entender mais sobre suas estruturas internas.
O nome átomo vem do grego atomos, que significa indivisível. Mas os físicos já sabem hoje que os átomos não são sólidos como pequenas esferas, e sim uma espécie de sistema planetário elétrico minúsculo.
Eles são constituídos por três partes principais: prótons, nêutrons e elétrons. Se os átomos já são extremamente pequenos, essas partículas subatômicas são ainda menores. Curiosamente, a primeira partícula a ser descoberta foi a menor de todas – o elétron.
Os átomos, nunca é demais lembrar, não são pedaços sólidos de matéria, mas sistemas que podem ser modificados ou passar por mudanças estruturais.
Com a estrutura do átomo descoberta, o que faltava era uma imagem – muita gente só acredita no que pode ver.
Nos anos 1930 isso era impossível, mas o trabalho de cientistas como Thomson, Rutherford e Chadwick ajudou a criar mecanismos para produzir essas imagens, com microscópios eletrônicos, que usam feixes de elétron em lugar de raios de luz.
Um feixe de luz tem comprimento de onda milhares de vezes maior do que um feixe de elétrons, que assim é capaz de ser desviado por átomos minúsculos para gerar uma imagem que a luz é incapaz de captar.
Mas os átomos não estão simplesmente presentes nas coisas de maneira estável, esperando para serem examinados. Muitas vezes, eles estão em decomposição, o que significa que são radioativos.
Há vários elementos naturalmente radioativos. O processo gera energia, que forma a base da energia nuclear – e das bombas nucleares. O trabalho dos físicos nucleares envolve geralmente tentar entender as reações nas quais o núcleo do átomo passa por mudanças fundamentais como essa.
Após mais de dois séculos de pesquisas, os cientistas não somente descobriram como os átomos são, mas também suas estruturas complexas e as suas mudanças – muitas das quais ocorrem naturalmente.
E, ao estudarmos os átomos dessa forma, fomos capazes de desenvolver novas tecnologias, aproveitar a energia de reações nucleares e entender melhor o mundo que nos cerca.
Para saber mais, clique nos links acima



Comentários
Postar um comentário